O instituto brasileiro pediu autorização para o uso de mais 4,8 milhões de doses do imunizante.
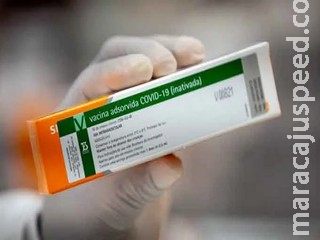
A Agência Nacional de Vigilância Sanitária (Anvisa) concluiu de forma “satisfatória” a primeira avaliação dos documentos encaminhados pelo Instituto Butantan referente ao segundo pedido de autorização de uso emergencial da Coronavac, vacina contra a Covid-19 desenvolvida em parceria com a farmacêutica chinesa Sinovac. O instituto brasileiro pediu autorização para o uso de mais 4,8 milhões de doses do imunizante.
A estimativa é que a agência leve no máximo 10 dias para avaliar os pedidos de uso emergencial, mas, neste caso, pode ser mais célere. Isso porque parte dos documentos sobre o produto já foi analisada pelo órgão ao liberar o uso de 6 milhões de doses do imunizante no último domingo, 17. A vacina já foi distribuída nos Estados e Distrito Federal.
De acordo com a agência, os dois pedidos são semelhantes, mas contêm diferenças importantes. O primeiro pedido era sobre vacinas importadas prontas. Já este, que ainda está em avaliação, trata de doses envasadas pelo próprio Butantan e em uma embalagem diferente. “Muitos documentos, estudos e dados são comuns aos dois pedidos. Não haverá retrabalho.”










Olá, deixe seu comentário!Logar-se!